Normas para la extracción de muestras para análisis
Dentro del área veterinaria, la mayoría de laboratorios tienen sus propias normas de identificación de muestras y formatos para la toma de muestras donde se incluyen los detalles de especie, raza, sexo, vacunaciones, anamnesis y diagnóstico clínico.
Para la adecuada toma, manejo, conservación y envío de las muestras, desde Uranolab facilitamos indicaciones precisas para el veterinario, según las pruebas clínicas que desee realizar en nuestro laboratorio.
El laboratorio Uranolab facilita el material necesario para la extracción de muestras. Para cualquier tipo de análisis fuera de catálogo contactar con el laboratorio clínico Uranolab.
- Depositar las muestras en los tubos correctos.
- Respetar los volúmenes necesarios en los tubos con anticoagulante.
- Trabajar en condiciones asépticas en Microbiología.
- Dejar reposar las muestras a temperatura ambiente 15 minutos y refrigerar a 4°C.
- NUNCA CONGELAR las muestras de sangre entera.
- Identificar todas las muestras y completar la hoja de petición.
Tipos de muestra
Sangre entera
EDTA: Hematología/Parásitos hemáticos
Litio-Heparina (uso en aves y reptiles, con eritrocitos nucleados)
Extraer la sangre de la vena evitando la hemólisis y llenar el tubo hasta al límite aconsejado (importante mantener la proporción entre sangre y anticoagulante). Extraer la muestra preferentemente de la vena Yugular. Se recomienda usar agujas de 21G o 22G para la extracción. Agitar el tubo con suavidad invirtiéndolo de 10 a 20 veces aproximadamente para evitar la formación de coágulos. Dejar reposar 15 minutos a temperatura ambiente y refrigerar a 4ºC. No congelar.
Plasma EDTA
Determinadas hormonas y bioquímicas especificadas en la tabla de análisis.
Seguir las indicaciones del apartado 1. El plasma se obtiene después de centrifugar la muestra a 2.000 rpm durante 10 minutos y traspasarlo a otro tubo seco. Refrigerar a 4ºC.
Plasma EDTA congelado
ACTH / Amonio
Las muestras para este tipo de pruebas se deben manipular rápidamente (no dejar reposar la muestra). Extraer la muestra de sangre (indicaciones apartado 1), centrifugarla a 2.000 rpm durante 10 minutos y separar el plasma traspasándolo a otro tubo seco. Congelar el plasma.
Avisar al Laboratorio de que se envía una muestra congelada y enviarla en un contenedor con hielo.
Plasma citrato
Coagulación
Seguir las instrucciones del apartado 1. La muestra debe de ser extraída preferentemente de la vena Yugular y en primera intención (debe ser una extracción limpia). Se recomienda el uso de agujas de 21G o 22G. Se puede citrar la aguja para evitar la formación de agregados y micro coágulos en el momento de la extracción. El plasma citrato se obtiene después de centrifugar la muestra a 2.000 rpm durante 10 minutos y traspasarlo a otro tubo sec. Refrigerar a 4ºC o congelar para conservar la muestra.
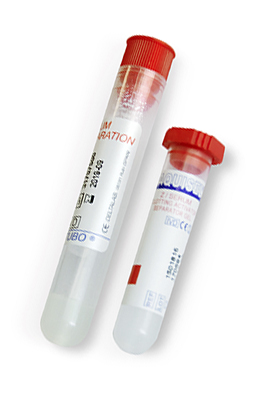
Suero
Serologí
Inmunología Clínica
Bioquímica*
Hormonas
Alergias
La muestra debe ser extraída preferentemente de la vena Yugular y sin aplicar una presión negativa excesiva para evitar la hemólisis. Se recomienda el uso de agujas de 21G o 22G para la extracción. Prever un volumen mínimo para el número de análisis que se tengan que realizar. Consultar los volúmenes mínimos en el listado de analíticas. Dejar reposar 15 minutos a temperatura ambiente para facilitar la formación del coágulo. El suero se obtiene después de centrifugar la muestra a 2.000 rpm durante 10 minutos. El gel separador mantendrá aislado el suero del componente celular no siendo necesario traspasarlo a otro tubo seco. Refrigerar a 4ºC.
*Los tubos de gel separador permiten determinar la Glucosa a condición de que hayan sido centrifugados después de la toma de la muestra.

Heces
Parásitos
Sangre oculta
Digestión
Coprocultivo
Las muestras deben ser frescas. Para el estudio de parásitos es recomendable la recolección de 2 o 3 deposiciones a lo largo del día. Para microbiología los contenedores tienen que ser estériles y se deben recoger las heces directamente del ano del animal. Refrigerar a 4ºC.

Orina
Urianálisis
Urinocultivo
Bioquímica
Si se prevé que hará falta realizar un cultivo, la cistocentesis es la mejor manera de tomar la muestra. Alternativamente, si no es posible hay que extraer la orina mediante un sondaje.
Si no es posible realizar ninguna de las extracciones anteriores, limpiar el área de micción y los genitales y recoger la orina directamente a mitad de micción. Con este método se pueden realizar las bioquímicas y el examen del sedimento, pero no es recomendable para cultivo.
Una vez tapado invertir el contenedor para asegurarnos de que no pierde contenido. Refrigerar la muestra a 4ºC y avisar al Laboratorio lo antes posible ya que la refrigeración puede facilitar la formación de cristales.
Es importante especificar el método de extracción en la hoja de petición para una correcta valoración de la muestra.
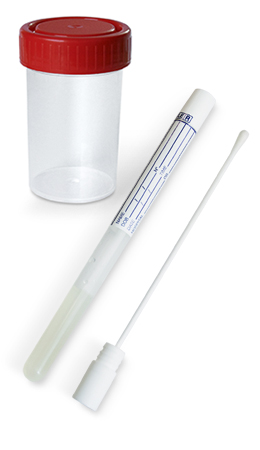
Microbiología
Contenedor estéril
Hisopo estéril con medio de transporte Amies
Usar guantes desinfectados con alcohol para la extracción de la muestra. En la toma para muestras no superficiales por punción es preciso usar una aguja de 21G o 22G y una jeringa estériles.
Desinfectar la superficie del cuerpo con alcohol de 70º (tomar 7 ml alcohol de 95º y 3 ml de suero fisiológico con una jeringa de 10 ml). Identificar la zona más representativa de la lesión y tomar las muestras en condiciones de máxima asepsia, evitando el contacto con la piel o zonas no estériles. En el caso de exudados limpiar la zona externa y coger muestra de la parte más profunda. En les lesiones purulentas intentar extraer la muestra con el mínimo de pus posible. Refrigerar a 4ºC
Realizar una extensión en un portaobjetos para facilitar el estudio de los microorganismos presentes en el momento de la extracción. Esto permitirá afinar más el diagnóstico.
Para las muestras de sangre es preciso solicitar un medio de transporte específico al Laboratorio.
Cuando se remiten órganos/líquidos biológicos para el cultivo, la extracción debe ser aséptica y las muestras se tienen que enviar en contenedores estériles.
Para cultivos micológicos realizar un raspado alrededor de las lesiones con una hoja de bisturí. Recoger muestra de más de una lesión procurando que no sangre ya que inhibe el crecimiento de los dermatofitos. Alternativamente arrancar los pelos con pinzas. Para cultivos trabajar con material estéril. No es necesario refrigerar la muestra.

Observación de hongos
Contenedor
Entre dos portaobjetos sellados
Realizar un raspado alrededor de las lesiones con una hoja de bisturí. Recoger muestra de más de una lesión. Alternativamente arrancar los pelos con pinzas. No es necesario refrigerar la muestra.
Las muestras con aceite y otros agentes no son válidas para la valoración de la fluorescencia. En caso necesario se puede usar suero fisiológico para mojar la piel y los pelos evitando que la muestra se esparza.
Para evaluar micoparasitológicos y tricogramas es necesario extraer la muestra por raspado y arrancado de pelos. La manera de enviar estas muestras es la misma que para hongos y parásitos dérmicos.

Observación de parásitos dérmicos
Entre dos portaobjetos sellados
Cinta adhesiva sobre portaobjetos
Tomar las muestras de diferentes lesiones. Raspar alrededor de las lesiones y en profundidad aunque se produzcan pequeñas hemorragias. Alternativamente, si hay sospecha de parásitos superficiales se pueden arrancar pelos y/o realizar un Scotch Tape Test (cinta adhesiva). Enviar les muestras entre dos porta-objetos sellados.
Para evaluar micoparasitológicos y tricogramas leer el punto “OBSERVACIÓN DE HONGOS“.
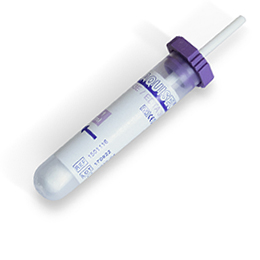
Moquillo en líquido conjuntival
Tomar suficiente muestra de exudado conjuntival con un hisopo limpio e introducirlo en un tubo EDTA. A continuación añadir suero fisiológico en volumen justo para cubrir el algodón del hisopo. Refrigerar a 4ºC.

Biopsia
Preparar las muestras lo antes posible (preferentemente durante los primeros 30 min después de la extracción).
Depositar las muestras en contenedores de plástico, de boca ancha con tapón de rosca, de cierre hermético. Añadir formol al 10% (1 vol. de formaldehido 35-40% + 9 vol. de agua corriente) hasta que cubra completamente la muestra. El volumen de formol debería ser idealmente 10 veces el volumen de la muestra (como mínimo 3) y la debería cubrir completamente. Si la muestra es grande realizar un corte profundo para mejorar la penetración del formol. Las muestras que flotan cubrirlas con una gasa gruesa.
Identificar los contenedores con el nombre del paciente. En caso de múltiples muestras identificarlas también tanto en el contenedor como en la hoja de petición.
Cumplimentar la hoja de petición con la máxima información relevante:
- Nombre del propietario
- Historial clínico
- Nombre y datos del paciente
- Tejido remitido

Citología
Realizar las extensiones inmediatamente después de la toma de muestras y dejar secar al aire. Si hay muestra sobrante (líquidos, médula ósea…) introducirla en un tubo con EDTA para evitar la coagulación. Si la citología es cutánea realizar improntas de la piel lesionada directamente sobre unos portaobjetos.
No es necesario fijar la muestra pero si se quiere, sumergir el portaobjetos en metanol (primera solución del kit de tinción Diff-Quick) durante 10 segundos. Si se sospecha de contenido graso no fijar la muestra. No es necesario teñir las extensiones.
Cumplimentar la hoja de petición con el máximo de información relevante posible.
Alergias
El diagnóstico de las alergias es complejo porque las respuestas de los animales afectados no son homogéneas. Las técnicas serológicas y las pruebas cutáneas sólo se pueden aplicar con garantías en procesos alérgicos de origen ambiental y en pocos casos a los derivados de una intolerancia alimentaria*.
Realizar una anamnesis precisa. El historial clínico es de vital importancia para el correcto diagnóstico de estos procesos. Antes de enviar cualquier muestra al Laboratorio hacer un tratamiento anti pulgas para ver si los síntomas remiten.
Tomar 3ml de sangre según el procedimiento del apartado "SUERO.
Cumplimentar la hoja de petición de análisis lo más detallada posible.
*Existen numerosos artículos científicos que demuestran la total falta de sensibilidad y especificidad de las pruebas serológicas en el diagnóstico de los procesos alimentarios.

Biología molecular
Las pruebas de amplificación del material genético son técnicas muy sensibles, pero delicadas. Si no se toman ciertas precauciones se pueden producir tanto falsos positivos como falsos negativos. Para un preciso uso de estas técnicas hace falta seguir las siguientes instrucciones:
Las muestras sobre las que se hace la amplificación están detalladas al lado del análisis en el apartado de BIOLOGÍA MOLECULAR.
Extraer las muestras lo más asépticamente posible. Las muestras líquidas (sangre entera y líquidos corporales) es preciso recogerlas en un tubo de EDTA o empaparlas en papel de filtro FTA. No usar tubos con Heparina para conservar la muestra; la Heparina inhibe la reacción de la polimerasa.
Las muestras de tejidos deben depositarse en contenedores estériles con suero fisiológico SIN FORMOL. Se pueden hacer improntas de tejidos sobre papel de filtro FTA.
Conservar las muestras a -20ªC hasta la recogida, excepto la sangre entera, que hay que mantenerla a 4ºC y los pelos que se pueden dejar a temperatura ambiente. Si se utilizan papeles de filtro FTA deben de conservarse a temperatura ambiente, dentro de una bolsa con el desecante.
Cumplimentar la hoja de petición con el máximo de información posible.

